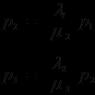Химические реакции оксидов металлов с водородом. Водород - это что за вещество? Химические и физические свойства водорода
В периодической системе имеет свое определенное место положения, которое отражает проявляемые им свойства и говорит о его электронном строении. Однако есть среди всех один особый атом, который занимает сразу две ячейки. Он располагается в двух совершенно противоположных по проявляемым свойствам группах элементов. Это водород. Такие особенности делают его уникальным.
Водород - это не просто элемент, но и простое вещество, а также составная часть многих сложных соединений, биогенный и органогенный элемент. Поэтому рассмотрим его характеристики и свойства подробнее.
Водород как химический элемент
Водород - это элемент первой группы главной подгруппы, а также седьмой группы главной подгруппы в первом малом периоде. Данный период состоит всего из двух атомов: гелия и рассматриваемого нами элемента. Опишем основные особенности положения водорода в периодической системе.
- Порядковый номер водорода - 1, количество электронов такое же, соответственно, протонов столько же. Атомная масса - 1,00795. Существует три изотопа данного элемента с массовыми числами 1, 2, 3. Однако свойства каждого из них очень сильно различаются, так как увеличение массы даже на единицу именно для водорода является сразу двойным.
- То, что на внешнем он содержит всего один электрон, позволяет успешно проявлять ему как окислительные, так и восстановительные свойства. Кроме того, после отдачи электрона у него остается свободная орбиталь, которая принимает участие в образовании химических связей по донорно-акцепторному механизму.
- Водород - это сильный восстановитель. Поэтому основным местом его считается первая группа главной подгруппы, где он возглавляет самые активные металлы - щелочные.
- Однако при взаимодействии с сильными восстановителями, такими как, например, металлы, он может быть и окислителем, принимая электрон. Данные соединения получили название гидридов. По этому признаку он возглавляет подгруппу галогенов, с которыми является схожим.
- Благодаря совсем маленькой атомной массе, водород считается самым легким элементом. Кроме того, его плотность также очень мала, поэтому он также является эталоном легкости.
Таким образом, очевидно, что атом водорода - это совершенно уникальный, непохожий на все остальные элемент. Следовательно, свойства его тоже особенные, а образуемые простые и сложные вещества очень важны. Рассмотрим их далее.

Простое вещество
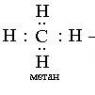
Если говорить о данном элементе как о молекуле, то нужно сказать, что она двухатомна. То есть водород (простое вещество) - это газ. Формула его эмпирическая будет записываться как Н 2 , а графическая - через одинарную сигма-связь Н-Н. Механизм образования связи между атомами - ковалентный неполярный.
- Паровая конверсия метана.
- Газификация угля - процесс подразумевает нагревание угля до 1000 0 С, в результате чего образуется водород и высокоуглеродный уголь.
- Электролиз. Данный метод может использоваться только для водных растворов различных солей, так как расплавы не приводят к разряжению воды на катоде.
Лабораторные способы получения водорода:
- Гидролиз гидридов металлов.
- Действие разбавленных кислот на активные металлы и средней активности.
- Взаимодействие щелочных и щелочноземельных металлов с водой.
Чтобы собрать образующийся водород, необходимо держать пробирку перевернутой вверх дном. Ведь данный газ нельзя собрать так, как, например, углекислый газ. Это водород, он намного легче воздуха. Быстро улетучивается, а в больших количествах при смешении с воздухом взрывается. Поэтому и следует переворачивать пробирку. После ее заполнения ее нужно закрыть резиновой пробкой.
Чтобы проверить чистоту собранного водорода, следует поднести к горлышку зажженную спичку. Если хлопок глухой и тихий - значит газ чистый, с минимальными примесями воздуха. Если же громкий и свистящий - грязный, с большой долей посторонних компонентов.

Области использования
При сгорании водорода выделяется настолько большое количество энергии (теплоты), что данный газ считается самым выгодным топливом. К тому же экологически чистым. Однако на сегодняшний день его применение в данной области ограничено. Это связано с непродуманными до конца и не решенными проблемами синтеза чистого водорода, который был бы пригоден для использования в качестве топлива в реакторах, двигателях и портативных устройствах, а также отопительных котлах жилых домов.
Ведь способы получения данного газа достаточно дорогостоящие, поэтому прежде необходимо разработать особый метод синтеза. Такой, который позволит получать продукт в большом объеме и с минимальными затратами.
Можно выделить несколько основных областей, в которых находит применение рассматриваемый нами газ.
- Химические синтезы. На основании гидрирования получают мыла, маргарины, пластмассы. При участии водорода синтезируется метанол и аммиак, а также другие соединения.
- В пищевой промышленности - как добавка Е949.
- Авиационная промышленность (ракетостроение, самолетостроение).
- Электроэнергетика.
- Метеорология.
- Топливо экологически чистого вида.
Очевидно, что водород так же важен, как и распространен в природе. Еще большую роль играют образуемые им различные соединения.

Соединения водорода
Это сложные, содержащие атомы водорода вещества. Можно выделить несколько основных типов подобных веществ.
- Галогеноводороды. Общая формула - HHal. Особое значение среди них имеет хлорид водорода. Это газ, который растворяется в воде с образованием раствора соляной кислоты. Данная кислота находит широкое применение практически во всех химических синтезах. Причем как органических, так и неорганических. Хлорид водорода - это соединение, имеющее эмпирическую формулу HCL и являющееся одним из крупнейших по объемам производства в нашей стране ежегодно. Также к галогеноводородам относятся йодоводород, фтороводород и бромоводород. Все они образуют соответствующие кислоты.
- Летучие Практически все они достаточно ядовитые газы. Например, сероводород, метан, силан, фосфин и прочие. При этом очень горючие.
- Гидриды - соединения с металлами. Относятся к классу солей.
- Гидроксиды: основания, кислоты и амфотерные соединения. В их состав обязательно входят атомы водорода, один или несколько. Пример: NaOH, K 2 , H 2 SO 4 и прочие.
- Гидроксид водорода. Это соединение больше известно как вода. Другое название оксид водорода. Эмпирическая формула выглядит так - Н 2 О.
- Пероксид водорода. Это сильнейший окислитель, формула которого имеет вид Н 2 О 2 .
- Многочисленные органические соединения: углеводороды, белки, жиры, липиды, витамины, гормоны, эфирные масла и прочие.
Очевидно, что разнообразие соединений рассматриваемого нами элемента очень велико. Это еще раз подтверждает его высокое значение для природы и человека, а также для всех живых существ.
- это лучший растворитель
Как уже упоминалось выше, простонародное название данного вещества - вода. Состоит из двух атомов водорода и одного кислорода, соединенных между собой ковалентными полярными связями. Молекула воды является диполем, это объясняет многие проявляемые ею свойства. В частности то, что она является универсальным растворителем.
Именно в водной среде происходят практически все химические процессы. Внутренние реакции пластического и энергетического обмена в живых организмах также осуществляются с помощью оксида водорода.
Вода по праву считается самым важным веществом на планете. Известно, что без нее не сможет жить ни один живой организм. На Земле она способна существовать в трех агрегатных состояниях:
- жидкость;
- газ (пар);
- твердое (лед).
В зависимости от изотопа водорода, входящего в состав молекулы, различают три вида воды.
- Легкая или протиевая. Изотоп с массовым числом 1. Формула - Н 2 О. Это привычная форма, которую используют все организмы.
- Дейтериевая или тяжелая, ее формула - D 2 O. Содержит изотоп 2 Н.
- Сверхтяжелая или тритиевая. Формула выглядит как Т 3 О, изотоп - 3 Н.
Очень важны запасы пресной протиевой воды на планете. Уже сейчас во многих странах ощущается ее недостаток. Разрабатываются способы обработки соленой воды с целью получения питьевой.

Пероксид водорода - это универсальное средство
Данное соединение, как уже упоминалось выше, прекрасный окислитель. Однако с сильными представителями может вести себя и как восстановитель тоже. Кроме того, обладает выраженным бактерицидным эффектом.
Другое название данного соединения - перекись. Именно в таком виде его используют в медицине. 3% раствор кристаллогидрата рассматриваемого соединения - это медицинское лекарство, которое применяют для обработки небольших ран с целью их обеззараживания. Однако доказано, что при этом заживление ранения по времени увеличивается.
Также пероксид водорода используется в ракетном топливе, в промышленности для дезинфекции и отбеливания, в качестве пенообразователя для получения соответствующих материалов (пенопласта, например). Кроме того, перекись помогает очищать аквариумы, обесцвечивать волосы и отбеливать зубы. Однако при этом наносит вред тканям, поэтому специалистами в этих целях не рекомендуется.
Водород. Свойства, получение, применение.Историческая справка
Водород – первый элемент ПСХЭ Д.И. Менделеева.
Русское название водорода указывает, что он «рождает воду»; латинское «гидрогениум» означает то же самое.
Впервые выделение горючего газа при взаимодействии некоторых металлов с кислотами наблюдали Роберт Бойль и его современники в первой половине XVI века.
Но водород был открыт лишь в 1766 году английским химиком Генри Кавендишем, который установил, что при взаимодействии металлов с разбавленными кислотами выделяется некий «горючий воздух». Наблюдая горение водорода на воздухе, Кавендиш установил, что в результате появляется вода. Это было в 1782 году.
В 1783 году году французский химик Антуан-Лоран Лавуазье выделил водород путем разложения воды раскаленным железом. В 1789 году водород был выделен при разложении воды под действием электрического тока.
Распространенность в природе
Водород – главный элемент космоса. Например, Солнце на 70 % своей массы состоит из водорода. Атомов водорода во Вселенной в несколько десятков тысяч раз больше, чем всех атомов всех металлов, вместе взятых.В земной атмосфере тоже есть немного водорода в виде простого вещества – газа состава Н 2 . Водород намного легче воздуха, и поэтому его находят в верхних слоях атмосферы.
Но гораздо больше на Земле связанного водорода: ведь он входит в состав воды, самого распространенного на нашей планете сложного вещества. Водород, связанный в молекулы, содержат и нефть, и природный газ, многие минералы и горные породы. Водород входит в состав всех органических веществ.
Характеристика элемента водорода.
Водород имеет двойственную природу, по этой причине в одних случаях водород помещают в подгруппу щелочных металлов, а в других – в подгруппу галогенов.
Электронная конфигурация 1s 1 . Атом водорода состоит из одного протона и одного электрона.
Атом водорода способен терять электрон и превращаться в катион H + , и в этом он сходен со щелочными металлами.
Атом водорода также может присоединять электрон, образуя при этом анион Н - , в этом отношении водород сходен с галогенами.
В соединениях всегда одновалентен
СО: +1 и -1.
Физические свойства водорода
Водород – это газ, без цвета, вкуса и запаха. В 14,5 раз легче воздуха. Мало растворим в воде. Обладает высокой теплопроводностью. При t= –253 °С – сжижается, при t= –259 °С – затвердевает. Молекулы водорода настолько малы, что способны медленно диффундировать через многие материалы – резину, стекло, металлы, что используется при очистке водорода от других газов.Известны 3 изотопа водорода: - протий, - дейтерий, - тритий. Основную часть природного водорода составляет протий. Дейтерий входит в состав тяжелой воды, которой обогащены поверхностные воды океана. Тритий – радиоактивный изотоп.
Химические свойства водорода
Водород – неметалл, имеет молекулярное строение. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью. Энергия связи в молекуле водорода составляет 436 кДж/моль, что объясняет низкую химическую активность молекулярного водорода.
Взаимодействие с галогенами. При обычной температуре водород реагирует лишь со фтором:
С хлором - только на свету, образуя хлороводород, с бромом реакция протекает менее энергично, с йодом не идет до конца даже при высоких температурах.
Взаимодействие с кислородом – при нагревании, при поджигании реакция протекает со взрывом: 2H 2 + O 2 = 2H 2 O.
Смесь из 1 части кислорода и 2 частей водорода – «гремучая смесь», наиболее взрывоопасна.
Взаимодействие с серой – при нагревании H 2 + S = H 2 S.
Взаимодействие с азотом. При нагревании, высоком давлении и в присутствии катализатора:
Взаимодействие с оксидом азота (II). Используется в очистительных системах при производстве азотной кислоты: 2NO + 2H 2 = N 2 + 2H 2 O.
Взаимодействие с оксидами металлов. Водород – хороший восстановитель, он восстанавливает многие металлы из их оксидов: CuO + H 2 = Cu + H 2 O.
Сильным восстановителем является атомарный водород. Он образуется из молекулярного в электрическом разряде в условиях низкого давления. Высокой восстановительной активностью обладает водород в момент выделения , образующийся при восстановлении металла кислотой.
Взаимодействие с активными металлами . При высокой температуре соединяется с щелочными и щелочно-земельными металлам и образуя белые кристаллические вещества – гидриды металлов, проявляя свойства окислителя: 2Na + H 2 = 2NaH;
Получение водорода
В лаборатории:
Взаимодействие металла с разбавленными растворами серной и соляной кислот,
Взаимодействие алюминия или кремния с водными растворами щелочей:
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2 .
В промышленности:
Электролиз водных растворов хлоридов натрия и калия или электролиз воды при присутствии гидроксидов:
2Н 2 О = 2Н 2 + О 2 .
Конверсионный способ. Вначале получают водяной газ, пропуская пары воды через раскаленный кокс при 1000 °С:
Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe 2 O 3:
CO +H 2 O = CO 2 + H 2 .
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
Конверсия метана: CH 4 + H 2 O = CO + 3H 2 .
Термическое разложение метана при 1200 °С: CH 4 = C + 2H 2 .
Глубокое охлаждение (до -196 °С) коксового газа. При этой температуре конденсируются все газообразные вещества, кроме водорода.
Применение водорода основано на его физических и химических свойствах:
как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
кислородно-водородное пламя применяется для получения высоких температур при сварки металлов;
как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
для получения аммиака и искусственного жидкого топлива, для гидрогенизации жиров.
В периодической системе водород располагается в двух абсолютно противоположных по своим свойствам группах элементов. Данная особенность делают его совершенно уникальным. Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.

Выделение горючего газа в процессе взаимодействия металлов и кислот наблюдали еще в XVI веке, то есть во время становления химии как науки. Известный английский ученый Генри Кавендиш исследовал вещество, начиная с 1766 года, и дал ему название «горючий воздух». При сжигании этот газ давал воду. К сожалению, приверженность ученого теории флогистона (гипотетической «сверхтонкой материи») помешала ему прийти к правильным выводам.
Французский химик и естествоиспытатель А. Лавуазье вместе с инженером Ж. Менье и при помощи специальных газометров в 1783 г. провел синтез воды, а после и ее анализ посредством разложения водяного пара раскаленным железом. Таким образом, ученые смогли прийти к правильным выводам. Они установили, что «горючий воздух» не только входит в состав воды, но и может быть получен из нее.
В 1787 году Лавуазье выдвинул предположение, что исследуемый газ является простым веществом и, соответственно, относится к числу первичных химических элементов. Он назвал его hydrogene (от греческих слов hydor - вода + gennao - рождаю), т. е. «рождающий воду».
Русское название «водород» в 1824 году предложил химик М. Соловьев. Определение состава воды ознаменовало конец «теории флогистона». На стыке XVIII и XIX веков было установлено, что атом водорода очень легкий (по сравнению с атомами прочих элементов) и его масса была принята за основную единицу сравнения атомных масс, получив значение, равное 1.
Физические свойства

Водород является легчайшим из всех известных науке веществ (он в 14,4 раз легче воздуха), его плотность составляет 0,0899 г/л (1 атм, 0 °С). Данный материал плавится (затвердевает) и кипит (сжижается), соответственно, при -259,1 °С и -252,8 °С (только гелий обладает более низкими t° кипения и плавления).
Критическая температура водорода крайне низка (-240 °С). По этой причине его сжижение - довольно сложный и затратный процесс. Критическое давление вещества - 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
Удельная теплоемкость вещества в тех же условиях - 14,208 кДж/(кгхК) или 3,394 кал/(гх°С). Данный элемент слабо растворим в воде (около 0,0182 мл/г при 1 атм и 20 °С), но хорошо - в большинстве металлов (Ni, Pt, Pa и прочих), особенно в палладии (примерно 850 объемов на один объем Pd).
С последним свойством связана его способность диффундирования, при этом диффузия через углеродистый сплав (к примеру, сталь) может сопровождаться разрушением сплава из-за взаимодействия водорода с углеродом (этот процесс называется декарбонизация). В жидком состоянии вещество очень легкое (плотность - 0,0708 г/см³ при t° = -253 °С) и текучее (вязкость - 13,8 спуаз в тех же условиях).

Во многих соединениях этот элемент проявляет валентность +1 (степень окисления), подобно натрию и прочим щелочным металлам. Обычно он рассматривается в качестве аналога этих металлов. Соответственно он возглавляет I группу системы Менделеева. В гидридах металлов ион водорода проявляет отрицательный заряд (степень окисления при этом -1), то есть Na+H- имеет структуру, подобную хлориду Na+Cl-. В соответствии с этим и некоторыми другими фактами (близость физических свойств элемента «H» и галогенов, способность его замещения галогенами в органических соединениях) Hydrogene относят к VII группе системы Менделеева.
В обычных условиях молекулярный водород имеет низкую активность, непосредственно соединяясь только с самыми активными из неметаллов (с фтором и хлором, с последним - на свету). В свою очередь, при нагревании он взаимодействует со многими химическими элементами.
Атомарный водород имеет повышенную химическую активность (если сравнивать с молекулярным). С кислородом он образует воду по формуле:
Н₂ + ½О₂ = Н₂О,
выделяя 285,937 кДж/моль тепла или 68,3174 ккал/моль (25 °С, 1 атм). В обычных температурных условиях реакция протекает довольно медленно, а при t° >= 550 °С - неконтролируемо. Пределы взрывоопасности смеси водород + кислород по объему составляют 4–94 % Н₂, а смеси водород + воздух - 4–74 % Н₂ (смесь из двух объемов Н₂ и одного объема О₂ называют гремучим газом).
Данный элемент используют для восстановления большинства металлов, так как он отнимает кислород у оксидов:
Fe₃O₄ + 4H₂ = 3Fe + 4Н₂О,
CuO + H₂ = Cu + H₂O и т. д.
С разными галогенами водород образует галогеноводороды, к примеру:
Н₂ + Cl₂ = 2НСl.
Однако при реакции с фтором водород взрывается (это происходит и в темноте, при -252 °С), с бромом и хлором реагирует только при нагревании или освещении, а с йодом - исключительно при нагревании. При взаимодействии с азотом образуется аммиак, но лишь на катализаторе, при повышенных давлениях и температуре:
ЗН₂ + N₂ = 2NН₃.
При нагревании водород активно реагирует с серой:
Н₂ + S = H₂S (сероводород),
и значительно труднее - с теллуром или селеном. С чистым углеродом водород реагирует без катализатора, но при высоких температурах:
2Н₂ + С (аморфный) = СН₄ (метан).
Данное вещество непосредственно реагирует с некоторыми из металлов (щелочными, щелочноземельными и прочими), образуя гидриды, например:
Н₂ + 2Li = 2LiH.
Немаловажное практическое значение имеют взаимодействия водорода и оксида углерода (II). При этом в зависимости от давления, температуры и катализатора образуются разные органические соединения: НСНО, СН₃ОН и пр. Ненасыщенные углеводороды в процессе реакции переходят в насыщенные, к примеру:
С n Н₂ n + Н₂ = С n Н₂ n ₊₂.
Водород и его соединения играют в химии исключительную роль. Он обусловливает кислотные свойства т. н. протонных кислот, склонен образовывать с разными элементами водородную связь, оказывающую значительное влияние на свойства многих неорганических и органических соединений.
Получение водорода
Основными видами сырья для промышленного производства этого элемента являются газы нефтепереработки, природные горючие и коксовые газы. Его также получают из воды посредством электролиза (в местах с доступной электроэнергией). Одним из важнейших методов производства материала из природного газа считается каталитическое взаимодействие углеводородов, в основном метана, с водяным паром (т. н. конверсия). Например:
СН₄ + H₂О = СО + ЗН₂.
Неполное окисление углеводородов кислородом:
СН₄ + ½О₂ = СО + 2Н₂.
Синтезированный оксид углерода (II) подвергается конверсии:
СО + Н₂О = СО₂ + Н₂.
Водород, производимый из природного газа, является самым дешевым.
Для электролиза воды применяется постоянный ток, который пропускается через раствор NaOH или КОН (кислоты не используют во избежание коррозии аппаратуры). В лабораторных условиях материал получают электролизом воды или в результате реакции между соляной кислотой и цинком. Однако чаще применяют готовый заводской материал в баллонах.
Из газов нефтепереработки и коксового газа данный элемент выделяют путем удаления всех остальных компонентов газовой смеси, так как они легче сжижаются при глубоком охлаждении.

Промышленным образом этот материал стали получать еще в конце XVIII века. Тогда его использовали для наполнения воздушных шаров. На данный момент водород широко применяют в промышленности, главным образом - в химической, для производства аммиака.
Массовые потребители вещества - производители метилового и прочих спиртов, синтетического бензина и многих других продуктов. Их получают синтезом из оксида углерода (II) и водорода. Hydrogene используют для гидрогенизации тяжелого и твердого жидкого топлива, жиров и пр., для синтеза HCl, гидроочистки нефтепродуктов, а также в резке/сварке металлов. Важнейшими элементами для атомной энергетики являются его изотопы - тритий и дейтерий.
Биологическая роль водорода
Около 10 % массы живых организмов (в среднем) приходится на этот элемент. Он входит в состав воды и важнейших групп природных соединений, включая белки, нуклеиновые кислоты, липиды, углеводы. Для чего он служит?
Этот материал играет решающую роль: при поддержании пространственной структуры белков (четвертичной), в осуществлении принципа комплиментарности нуклеиновых кислот (т. е. в реализации и хранении генетической информации), вообще в «узнавании» на молекулярном уровне.
Ион водорода Н+ принимает участие в важных динамических реакциях/процессах в организме. В том числе: в биологическом окислении, которое обеспечивает живые клетки энергией, в реакциях биосинтеза, в фотосинтезе у растений, в бактериальном фотосинтезе и азотфиксации, в поддержании кислотно-щелочного баланса и гомеостаза, в мембранных процессах транспорта. Наряду с углеродом и кислородом он образует функциональную и структурную основы явлений жизни.
Гидроген Н - химический элемент, один из самых распространённых в нашей Вселенной. Масса водорода как элемента в составе веществ составляет 75 % от общего содержания атомов другого типа. Он входит в наиважнейшее и жизненно необходимое соединение на планете - воду. Отличительной особенностью водорода также является то, что он первый элемент в периодический системе химических элементов Д. И. Менделеева.
Открытие и исследование
Первые упоминания о водороде в трудах Парацельса датируются шестнадцатым веком. Но его выделение из газовой смеси воздуха и исследование горючих свойств были произведены уже в семнадцатом веке учёным Лемери. Досконально изучил гидроген английский химик, физик и естествоиспытатель который опытным путём доказал, что масса водорода наименьшая в сравнении с другими газами. В последующих этапах развития науки многие учёные работали с ним, в частности Лавуазье, назвавший его «рождающим воду».
Характеристика по положению в ПСХЭ
Элемент, открывающий периодическую таблицу Д. И. Менделеева, - это водород. Физические и химические свойства атома проявляют некую двойственность, так как гидроген одновременно относят к первой группе, главной подгруппе, если он ведёт себя как металл и отдаёт единственный электрон в процессе химической реакции, и к седьмой - в случае полного заполнения валентной оболочки, то есть приёме отрицательной частицы, что характеризует его как подобный галогенам.

Особенности электронного строения элемента
Свойства сложных веществ, в состав которых он входит, и самого простого вещества Н 2 в первую очередь определяются электронной конфигурацией гидрогена. Частица имеет один электрон с Z= (-1), который вращается по своей орбите вокруг ядра, содержащего один протон с единичной массой и положительным зарядом (+1). Его электронная конфигурация записывается как 1s 1 , что означает наличие одной отрицательной частицы на самой первой и единственной для гидрогена s-орбитали.
При отрыве или отдаче электрона, а атом этого элемента имеет такое свойство, что роднит его с металлами, получается катион. По сути ион водорода - это положительная элементарная частица. Поэтому лишенный электрона гидроген называют попросту протоном.

Физические свойства
Если описывать водорода кратко, то это бесцветный, малорастворимый газ с относительной атомной массой равной 2, в 14,5 раза легче, чем воздух, с температурой сжижения, составляющей -252,8 градуса Цельсия.
На опыте можно легко убедиться в том, что Н 2 самый легкий. Для этого достаточно наполнить три шара различными веществами - водородом, углекислым газом, обычным воздухом - и одновременно выпустить их из руки. Быстрее всех достигнет земли тот, который наполнен СО 2 , после него опустится надутый воздушной смесью, а содержащий Н 2 вовсе поднимется к потолку.
Маленькая масса и размер частиц водорода обосновывают его способность проникать через различные вещества. На примере того же шара в этом легко убедиться, через пару дней он сам сдуется, так как газ просто пройдёт через резину. Также водород может накапливаться в структуре некоторых металлов (палладий или платина), а при повышении температуры испаряться из неё.
Свойство малорастворимости водорода используют в лабораторной практике для его выделения способом вытеснения водорода (таблица, изображенная ниже, содержит основные параметры) определяют сферы его применения и методы получения.
| Параметр атома или молекулы простого вещества | Значение |
| Атомная масса (молярная масса) | 1,008 г/моль |
| Электронная конфигурация | 1s 1 |
| Кристаллическая решётка | Гексагональная |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Плотность при н. у. | 0,08987 г/л |
| Температура кипения | -252,76 °C |
| Удельная теплота сгорания | 120,9·10 6 Дж/кг |
| Температура плавления | -259,2 °C |
| Растворимость в воде | 18,8 мл/л |
Изотопный состав
Как и многие другие представители периодической системы химических элементов, гидроген имеет несколько природных изотопов, то есть атомов с одинаковым числом протонов в ядре, но различным числом нейтронов - частиц с нулевым зарядом и единичной массой. Примеры атомов, обладающих подобным свойством - кислород, углерод, хлор, бром и прочие, в том числе радиоактивные.
Физические свойства водорода 1 Н, самого распространённого из представителей данной группы, значительно отличаются от таких же характеристик его собратьев. В частности, разнятся особенности веществ, в состав которых они входят. Так, существует обычная и дейтерированная вода, содержащая в своём составе вместо атома водорода с одним-единственным протоном дейтерий 2 Н - его изотоп с двумя элементарными частицами: положительной и незаряженной. Этот изотоп в два раза тяжелее обычного гидрогена, что и объясняет кардинальное различие в свойствах соединений, которые они составляют. В природе дейтерий встречается в 3200 раз реже, чем водород. Третий представитель - тритий 3 Н, в ядре он имеет два нейтрона и один протон.

Способы получения и выделения
Лабораторные и промышленные методы весьма отличаются. Так, в малых количествах газ получают в основном с помощью реакций, в которых участвуют минеральные вещества, а крупномасштабные производства в большей степени используют органический синтез.
В лаборатории применяют следующие химические взаимодействия:

В промышленных интересах газ получают такими методами, как:
- Термическое разложение метана в присутствии катализатора до составляющих его простых веществ (350 градусов достигает значение такого показателя, как температура) - водорода Н 2 и углерода С.
- Пропускание парообразной воды через кокс при 1000 градусов Цельсия с образованием углекислого газа СО 2 и Н 2 (самый распространённый метод).
- Конверсия газообразного метана на никелевом катализаторе при температуре, достигающей 800 градусов.
- Водород является побочным продуктом при электролизе водных растворов хлоридов калия или натрия.
Химические взаимодействия: общие положения
Физические свойства водорода во многом объясняют его поведение в процессах реагирования с тем или иным соединением. Валентность гидрогена равняется 1, так как он в таблице Менделеева расположен в первой группе, а степень окисления проявляет различную. Во всех соединениях, кроме гидридов, водород в с.о.= (1+), в молекулах типа ХН, ХН 2 , ХН 3 - (1-).
Молекула газа водорода, образованная посредством создания обобщенной электронной пары, состоит из двух атомов и довольно устойчива энергетически, именно поэтому при нормальных условиях несколько инертна и в реакции вступает при изменении нормальных условий. В зависимости от степени окисления водорода в составе прочих веществ, он может выступать как в качестве окислителя, так и восстановителя.

Вещества, с которыми реагирует и которые образует водород
Элементные взаимодействия с образованием сложных веществ (часто при повышенных температурах):
- Щелочной и щелочноземельный металл + водород = гидрид.
- Галоген + Н 2 = галогеноводород.
- Сера + водород = сероводород.
- Кислород + Н 2 = вода.
- Углерод + водород = метан.
- Азот + Н 2 = аммиак.
Взаимодействие со сложными веществами:
- Получение синтез-газа из монооксида углерода и водорода.
- Восстановление металлов из их оксидов с помощью Н 2 .
- Насыщение водородом непредельных алифатических углеводородов.
Водородная связь
Физические свойства водорода таковы, что позволяют ему, находясь в соединении с электроотрицательным элементом, образовывать особый тип связи с таким же атомом из соседних молекул, имеющих неподелённые электронные пары (например, кислородом, азотом и фтором). Ярчайший пример, на котором лучше рассмотреть подобное явление, - это вода. Она, можно сказать, прошита водородными связями, которые слабее ковалентных или ионных, но за счёт того, что их много, оказывают значительное влияние на свойства вещества. По сути, водородная связь - это электростатическое взаимодействие, которое связывает молекулы воды в димеры и полимеры, обосновывая её высокую температуру кипения.
Гидроген в составе минеральных соединений
В состав всех входит протон - катион такого атома, как водород. Вещество, кислотный остаток которого имеет степень окисления больше (-1), называется многоосновным соединением. В нём присутствует несколько атомов водорода, что делает диссоциацию в водных растворах многоступенчатой. Каждый последующий протон отрывается от остатка кислоты всё труднее. По количественному содержанию водородов в среде определяется его кислотность.

Применение в деятельности человека
Баллоны с веществом, так же как и емкости с другими сжиженными газами, например кислородом, имеют специфический внешний вид. Они выкрашены в темновато-зелёный цвет с ярко-красной надписью «Водород». Газ закачивают в баллон под давлением порядка 150 атмосфер. Физические свойства водорода, в частности легкость газообразного агрегатного состояния, используют для наполнения им в смеси с гелием аэростатов, шаров-зондов и т.д.
Водород, физические и химические свойства которого люди научились использовать много лет назад, на сегодняшний момент задействован во многих отраслях промышленности. Основная его масса идёт на производство аммиака. Также водород участвует в (гафния, германия, галлия, кремния, молибдена, вольфрама, циркония и прочих) из окислов, выступая в реакции в качестве восстановителя, синильной и соляной кислот, а также искусственного жидкого топлива. Пищевая промышленность использует его для превращения растительных масел в твёрдые жиры.
Определили химические свойства и применение водорода в различных процессах гидрогенизации и гидрирования жиров, углей, углеводородов, масел и мазута. С помощью него производят драгоценные камни, лампы накаливания, проводят ковку и сварку металлических изделий под воздействием кислородно-водородного пламени.
Строение и физические свойства водорода Водород - двухатомный газ Н2. Он не имеет ни цвета, ни запаха. Это самый легкий газ. Благодаря этому свойству он использовался в аэростатах, дирижаблях и тому подобных устройствах, однако широкому применению водорода в этих целях мешает его взрывоопасность в смеси с воздухом.
Молекулы водорода неполярные и очень маленькие, поэтому взаимодействие между ними мало. В связи с этим он имеет очень низкие температуры плавления (-259оС) и кипения (-253оС). Водород практически нерастворим в воде.
Водород имеет 3 изотопа: обычный 1Н, дейтерий 2H или D, и радиоактивный тритий 3Н или Т. Тяжелые изотопы водорода уникальны тем, что тяжелее обычного водорода в 2 или даже в 3 раза! Именно поэтому замена обычного водорода на дейтерий или тритий заметно сказывается на свойствах вещества (так, температуры кипения обычного водорода Н2 и дейтерия D2 различаются на 3,2 градуса). Взаимодействие водорода с простыми веществами Водород - неметалл среднейэлектроотрицательности. Поэтому ему присущи и окислительные, и восстановительные свойства.
Окислительные свойства водорода проявляются в реакциях с типичными металлами - элементами главных подгрупп I-II группы таблицы Менделеева. Самые активные металлы (щелочные и щелочноземельные) при нагревании с водородом дают гидриды – твердые солеобразные вещества, содержащие в кристаллической решетке гидрид-ион Н-. 2Na + Н2 = 2NaН ; Са + Н2 = СаН2 Восстановительные свойства водорода проявляются в реакциях с более типичными неметаллами, чем водород: 1) Взаимодействие с галогенами H2 + F2 = 2HF
Аналогично протекает взаимодействие с аналогами фтора - хлором, бромом, иодом. По мере уменьшения активности галогена интенсивность протекания реакции уменьшается. Реакция с фтором происходит при обычных условиях со взрывом, для реакции с хлором требуется освещение или нагревание, а реакция с иодом протекает лишь при сильном нагревании и обратимо. 2) Взаимодействие с кислородом 2Н2 + О2 = 2Н2О Реакция протекает с большим выделением тепла, иногда со взрывом. 3) Взаимодействие с серой Н2 + S = H2S Сера - гораздо менее активный неметалл, чем кислород, и взаимодействие с водородом протекает спокойно.Ь 4) Взаимодействие с азотом 3Н2 + N2↔ 2NH3 Реакция обратима, протекает в заметной степени только в присутствии катализатора, при нагревании и под давлением. Продукт называется аммиак. 5) Взаимодействие с углеродом С + 2Н2↔ СН4 Реакция протекает в электрической дуге или при очень высоких температурах. В качестве побочных продуктов образуются и другие углеводороды. 3. Взаимодействие водорода со сложными веществами Водород проявляет восстановительные свойства и в реакциях со сложными веществами: 1) Восстановление оксидов металлов, стоящих в электрохимическом ряду напряжений правее алюминия, а также оксиды неметаллов: Fe2O3 + 2H2 2Fe + 3H2O; CuO + H2 Cu + H2OВодород применяют как восстановитель для извлечения металлов из оксидных руд. Реакции идут при нагревании.2) Присоединение к органическим непредельным веществам; С2Н4 + Н2(t;p)→ С2Н6 Реакции протекают в присутствии катализатора и под давлением. Других реакций водорода мы пока касаться не будем. 4. Получение водорода В промышленности водород получают переработкой углеводородного сырья - природного и попутного газа, кокса и т.п. Лабораторные методы получения водорода:
1) Взаимодействие металлов, стоящих в электрохимическом ряду напряжений металлов левее водорода, с кислотами. Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Mg + 2HCl = MgCl2 + H22) Взаимодействие металлов, стоящих в электрохимическом ряду напряжений металлов левее магния, с холодной водой. При этом также образуется щелочь.
2Na + 2H2O = 2NaOH + H2 Металл, находящийся в электрохимическом ряду напряжений металлов левее марганца, способен вытеснять водород из воды при определенных условиях (магний - из горячей воды, алюминий - при условии снятия оксидной пленки с поверхности).
Mg + 2H2O Mg(OH)2 + H2
Металл, находящийся в электрохимическом ряду напряжений металлов левее кобальта, способен вытеснять водород из водяного пара. При этом также образуется оксид.
3Fe + 4H2Oпар Fe3O4 + 4H23) Взаимодействие металлов, гидроксиды которых амфотерны, с растворами щелочей.
Металлы, гидроксиды которых амфотерны, вытесняют водород из растворов щелочей. Вам необходимо знать 2 таких металла - алюминий и цинк:
2Al + 2NaOH +6H2O = 2Na + + 3H2
Zn + 2KOH + 2H2O = K2 + H2
При этом образуются комплексные соли - гидроксоалюминаты и гидроксоцинкаты.
Все методы, перечисленные до сих пор, основаны на одном и том же процессе - окислении металла атомом водорода в степени окисления +1:
М0 + nН+ = Мn+ + n/2 H2
4) Взаимодействие гидридов активных металлов с водой:
СаН2 + 2Н2О = Са(ОН)2 + 2Н2
Этот процесс основан на взаимодействии водорода в степени окисления -1 с водородом в степени окисления +1:
5) Электролиз водных растворов щелочей, кислот, некоторых солей:
2Н2О 2Н2 + О2
5. Водородные соединения В этой таблице слева легкой тенью выделены клетки элементов, образующих с водородом ионные соединения - гидриды. Эти вещества имеют в своем составе гидрид-ион Н-. Они представляют собой твердые бесцветные солеобразные вещества и реагируют с водой с выделением водорода.
Элементы главных подгрупп IV-VII групп образуют с водородом соединения молекулярного строения. Иногда их также называют гидридами, но это некорректно. В их составе нет гидрид-иона, они состоят из молекул. Как правило, простейшие водородные соединения этих элементов - бесцветные газы. Исключения - вода, являющаяся жидкостью, и фтороводород, который при комнатной температуре газообразен, но при нормальных условиях - жидкость.
Темными клетками отмечены элементы, образующие с водородом соединения, проявляющие кислотные свойства.
Темными клетками с крестом обозначены элементы, образующие с водородом соединения, проявляющие основные свойства.
=================================================================================
29). общая характеристика свойств элементов главной подгруппы 7гр. Хлор. Свойства лора. Соляная кислота. В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат - радиоактивный элемент, изучен мало). Это р-элементы VII группы периодической системы Д.И.Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств.
Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значениястепеней окисления объясняются электронным строением, которое у атомов фтора можно представитьсхемой
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р подуровень.У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1.
Электронное строение атома хлора выражается схемойУ атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов.
У фтора нет свободных орбиталей,а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрениисвойств галогенов всегда надо учитывать особенности фтора и соединений.
Водные растворы водородных соединений галогенов являются кислотами: НF - фтороводородная (плавиковая), НСl - хлороводородная (соляная),НВr - бромводородная, НI - йодоводородная.
Хлор (лат.Chlorum), Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству галогенов. При нормальных условиях (0°С, 0,1 Мн/м2, или 1 кгс/см2) желто-зеленый газ с резким раздражающим запахом. Природный Хлор состоит из двух стабильных изотопов: 35Сl (75,77%) и 37Cl (24,23%).
Химические свойства Хлора. Внешняя электронная конфигурация атома Cl 3s2Зр5. В соответствии с этим Хлор в соединениях проявляет степени окисления -1,+1, +3, +4, +5, +6 и +7. Ковалентный радиус атома 0,99Å, ионный радиус Cl- 1.82Å, сродство атома Хлора к электрону 3,65 эв, энергия ионизации 12,97 эв.
Химически Хлор очень активен, непосредственно соединяется почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании) и с неметаллами (кроме углерода, азота, кислорода, инертных газов), образуя соответствующие хлориды, вступает в реакцию со многими соединениями, замещает водород в предельных углеводородах и присоединяется к ненасыщенным соединениям. Хлор вытесняет бром и иод из их соединений с водородом и металлами; из соединений Хлора с этими элементами он вытесняется фтором. Щелочные металлы в присутствии следов влаги взаимодействуют с Хлором с воспламенением, большинство металлов реагирует с сухим Хлором только при нагревании Фосфор воспламеняется в атмосфере Хлора, образуя РCl3, а при дальнейшем хлорировании - РСl5; сера с Хлором при нагревании дает S2Cl2, SCl2 и другие SnClm. Мышьяк, сурьма, висмут, стронций, теллур энергично взаимодействуют с Хлором. Смесь Хлора с водородом горит бесцветным или желто-зеленым пламенем с образованием хлористого водорода (это цепная реакция). С кислородом Хлор образует оксиды: Cl2О, СlO2, Cl2О6, Сl2О7, Cl2О8, а также гипохлориты (соли хлорноватистой кислоты), хлориты, хлораты и перхлораты. Все кислородные соединения хлора образуют взрывоопасные смеси с легко окисляющимися веществами. Хлор в воде гидролизуется, образуя хлорноватистую и соляную кислоты: Cl2 + Н2О = НClО + НCl. При хлорировании водных растворов щелочей нахолоду образуются гипохлориты и хлориды: 2NaOH + Cl2= NaClO + NaCl + Н2О, а при нагревании - хлораты. Хлорированием сухого гидрооксида кальция получают хлорную известь. При взаимодействии аммиака с Хлором образуется треххлористый азот. При хлорировании органических соединений Хлор либо замещает водород, либо присоединяется по кратным связям, образуя различные хлорсодержащие органических соединения. Хлор образует с других галогенами межгалогенные соединения. Фториды ClF, ClF3, ClF3 очень реакционноспособны; например, в атмосфере ClF3 стеклянная вата самовоспламеняется. Известны соединения хлора с кислородом и фтором - оксифториды Хлора: ClO3F, ClO2F3, ClOF, ClOF3 и перхлорат фтора FClO4. Соля́ная кислота́ (хлороводоро́дная, хлористоводоро́дная, хлористый водород) - HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38% по массе. Соли соляной кислоты называются хлоридами.
Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуетсятворожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
===============================================================================